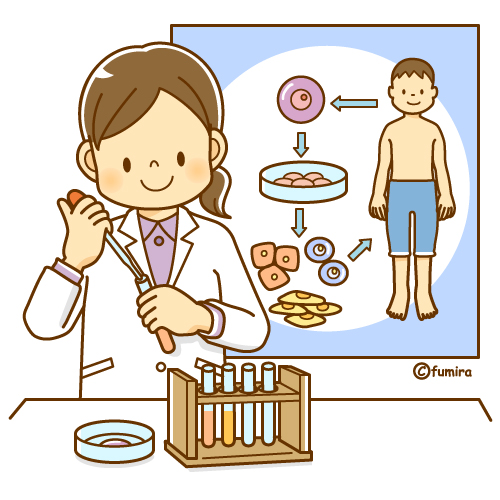
厚生労働省の専門部会は21日、脊髄損傷患者の運動や知覚の機能回復を狙う再生医療製品について条件付きで製造販売を承認するよう厚労相に答申することを決めた。製品は患者の骨髄液から採取した幹細胞を培養し点滴で戻すもので、年内にも正式承認される。
厚労省によると、脊髄損傷への再生医療製品の販売承認は世界初とみられる。 製品はニプロが6月に申請した「ステミラック注」で、脊髄損傷から約2週間までの、運動や知覚の機能が全くないか一部残る患者が対象。最大50ミリリットルの骨髄液や血液を採取し、骨髄液に含まれる幹細胞「間葉系幹細胞」を約2~3週間で5000万~2億個に培養した後、静脈に点滴で戻す。脊髄には脳からの指令を手足に伝える神経が束で集まる。戻された幹細胞が神経の周辺に集まり、炎症を抑えて神経細胞の再生を促す成分を放出し、患者の機能が改善することを狙う。
【文責】登坂紀一朗(薬剤師)





